仿制药一致性评价中的博弈及政策建议
摘要
目的:探讨政府促进国内制药企业(简称药企)参与仿制药一致性评价的最优决策。方法:利用博弈论方法分析国内药企与政府在仿制药一致性评价问题的博弈均衡。结果:可能会产生两种均衡,一种是地方各级政府相关部门均严格执行一致性评价政策,药企则选择积极参与一致性评价;另一种是地方各级政府相关部门执行政策不统一,如适当“延期”,且在省级带量采购中允许非过评品种中标,那么可能会导致部分药企过评积极性不大,因为不参加一致性评价的成本更低。结论:为鼓励仿制药企业参与一致性评价,地方各级政府相关部门应严格执行一致性评价政策,同时应出台相关配套和激励措施,如带量采购、优先审评和审批等,提高过评企业的净收益。
关键词:仿制药;一致性评价;博弈;成本;利润;政府
Policy Game and Government Countermeasures on Consistency Evaluation of Generic Drugs
Key words:generic drugs;consistency evaluation;game theory;cost;profit;government
中图分类号:R954 文献标志码:A
2016年2月,《国务院办公厅关于开展仿制药质量和疗效一致性评价的意见》(国办发〔2016〕8号)中提出,首批需要开展一致性评价的仿制药有289个品种。据不完全统计,共涉及17740个批准文号/注册证号,1817家国内药品生产企业和42家进口药品企业。当同品种药品通过一致性评价的生产企业达3家时,药品集中采购就不再选用未通过一致性评价的品种;且第1家品种通过一致性评价后,3年后不再受理其他药品生产企业相同品种一致性评价的申请。以此提高我国仿制药的质量和疗效,加速行业洗牌,鼓励国内制药企业(简称国内药企)加大研发力度,通过产品质量和价格竞争实现行业聚集效应。通过一致性评价是带量采购的前提条件,其提高了以公立医疗市场为主要销售终端的国内药企的市场门槛。因此,企业必然会权衡利弊,分析决策成本和利润情况,选择是否进行仿制药一致性评价。本研究中利用博弈论分析国内药企与政府在仿制药一致性评价问题上的博弈均衡,并提出促进国内药企参与仿制药一致性评价的建议。现报道如下。
1.制药企业对待一致性评价的理性决策
1.1 无市场风险时药企决策
假设国内药企为某种药品进行一致性评价的投资成本为C,当前这种药品的每年净利润为π前,通过一致性评价后每年净利润为π后,令π后>π前。假设每年净利润不变,该药品分摊的固定成本忽略不计,市场利率为γ,且不变;那么国内药企通过一致性评价后每年利润为π后/(1+γ),折算到年初的现值为π后/(1+γ)n,当n→∞时,现值为π后/γ,只有现值大于期初一致性评价的投资时,该企业才会选择一致性评价,即π后/γ>C。事实上,当前一致性评价投资约为1000万元,假设市场利率为10%,只要通过仿制药一致性评价的药品每年能给企业带来100万元以上的净利润,企业就会有动力进行一致性评价。按利率为10%计算,该药品增加销售额只要超过1000万元即可,估计许多企业都 能实现,但事实上真正实施仿制药一致性评价的企业比例并不高。
1.2 市场不确定性制约企业决策
根据《总局关于仿制药质量和疗效一致性评价工作有关事项的公告(2017年第100号)》规定,企业参加国家带量采购的前提条件是通过一致性评价,若假定企业能确定每年得到100万元净利润,那么这些企业必然会做出实施仿制药一致性评价的决策,但在实施过程中存在一定风险。主要风险有药品是否能通过一致性评价,药品是否能获得100万元净利润。假设这2种风险出现的概率分别为r1和r2,则企业选择一致性评价的r1r2π后/γ>C(公式1),π后>γC/r1r2。可见,在其他条件不变,且r1和r2值较大,风险较小时,药企越会选择一致性评价;反之,则会拒绝。
2.制药企业与政府的博弈
依据原国家食品药品监督管理局要求,截至2018 年底,《国家基本药物目录(2012年版)》中2007年10月1日前批准上市的化学药品仿制药口服固体制剂 (289个目录品种)应在2018年底前完成一致性评价。其中,需开展临床有效性试验和存在特殊情形的品种应在2021年底前完成一致性评价。逾期未完成的,不予再注册。政府在促使企业参与仿制药一致性评价时,还需考虑医保支付情况及药品供应问题。根据《国家药品监督管理局关于仿制药质量和疗效一致性评价有关事项的公告(2018年第102号)》,在2018年12月31日前未完成仿制药一致性评价的,“企业经评估认为属于临床必需、市场短缺品种的,可向所在地省级药品监管部门提出延期评价申请,经省级药品监管部门会同卫生行政部门组织研究认定后,可予适当延期。逾期再未完成的,不予再注册。”因此,会有两种策略,一是严格执行该文件,二是适当延期,甚至在省级带量采购中也允许为过评品种中标;国内药企也会有2种策略,一是参与,二是放弃。在政府严格执行该文件和企业参与一致性评价的前提下,企业净收益为r1r2π后/γ-C,如果企业放弃、政府严格执行该文件的条件下,制药企业就会损失前的市场收益,设为-π前/γ。若政府考虑到多数企业未能及时参与一致性评价,则会适当“延期”,即还会采购未通过一致性评价的仿制药。此时,参与一致性评价的企业由于前期投入成本较高,可能不会有太多的市场扩容,要独自承担一致性评价的投资成本(-C),其净收益为π前-C,未参与则会得到之前的利润(π前)。由于仿制药的进入,会与原研药产生有效竞争,政府可减少医保支出,设为C政,若没有企业参与,政府还要严格 执行该文件,可能会让原研药垄断医院市场。此时,政府需要支出较高的医保支出,高出部分设为-C原垄,若政府适当“延期”,药企放弃参与时,政府会承担潜在的损失,即药企参与一致性评价时的成本结余,净收益为-C政 。由此可得到政府与国内制药企业间的博弈矩阵,详见下图。
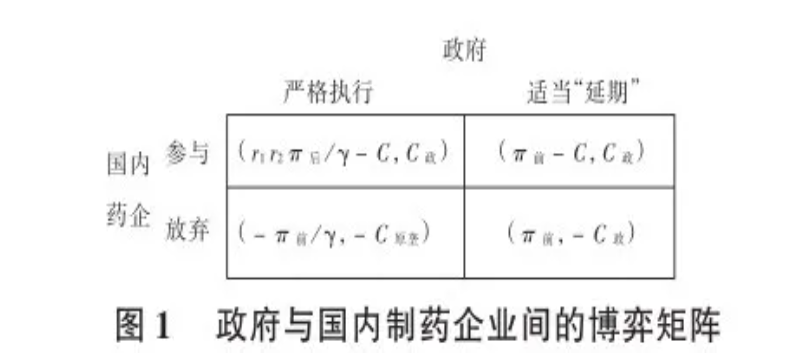
可见,若政府先行动,严格执行该文件,国内药企选择参与决策时,r1r2π后/γ-C>-π前/γ,即r1r2π后/γ+π前/γ>C(公式2)。与公式1相比,公式2更易满足,即只要政府下定决心,严格执行一致性评价政策,制药企业则更愿意参与一致性评价。2016年至2018年年初,申请参加一致性评价的企业较少,此后参与企业增多,这也验证了这种推理。
国内药企也可选择“将军”策略,即集体默契合谋,选择放弃参与。此时,政府若严格执行该文件,就会承担一定的原研药垄断成本,如果该成本较高,则政府备受财政压力,可能会选择“延期”策略,即当-C原垄 <-C政 时,政府选择适当“延期”属占优策略。一旦这种倾向被国内药企所获悉,那么基于利益考虑,必然会选择放弃策略,此时国内药企和政府间的博弈均衡为放弃和适当“延期”。
3.政策建议
3.1 政府严格执行政策,推动企业参与一致性评价
如果政府严格执行过评品种实现带量采购等策略,那么国内药企必然会有较大的积极性参加一致性评价。若参与过评企业较少(如没有过评品种)时,政府可通过医保谈判政策,迫使过期原研药降价,或鼓励新药研发,通过医保谈判尽快纳入医保,实现同类品种替代。这种均衡结果既鼓励新药研发,又能让患者用上高质量的药物。此时,政府可能面临较大的医保支出压力,但从长期来看,理性企业会选择过评,与原研药争夺市场。同样,未参与一致性评价的国内药企承担的压力会更大,特别是那些以医院市场为主渠道的国内药企,一旦失去这个市场,甚至失去某些批文,则意味着退出行业。因此,只有政府下定决心,释放出一定要推进仿制药一致性评价的信号,才会让那些观望的国内药企参与一致性评价。当前,我国3次带量采购中标结果显示,绝大部分过评仿制药实现原研替代,过期原研药逐渐退出公立医疗市场,国内药企实现市场规模“从零到1,从1到10”的跨越。从而实现双赢,即政府节省医保支出,国内药企扩大市场规模,实现正常利润。
3.2 政府制定配套政策,降低企业过评成本
在我国现行的医疗市场中,由于外资药企依靠强大的技术和学术营销资源,其原研药即使过了专利期,依然会占据大部分市场,如波立维过专利期后5年,我国市场占有率依然为58.7%,下降了16.8%,而在全球市场中下降了82.9%。带量采购,“以量换价,保证回款”是一个很好的配套政策,若真正执行到底,就能彻底打通仿制药一致性评价的市场通路,提高通过仿制药一致性评价后的药品增加销量概率(r2)。同时,若能将药品费用节省部分归医院甚至医师所有,则可激励医师开具价格更低的仿制药。当前,我国政府正在推行疾病诊断相关分组(DRG)付费试点,目的是激励医师处方带量采购中标品种(前提是过评),提高通过一致性评价药品的市场销售额,增加r2π后。如美国1994年仿制药使用量仅为12%,而2000年达44%,2007年达75%。
3.3 政府合理激励过评企业
自仿制药一致性评价政策执行以来,我国各地政府制定相应政策,鼓励本地区企业积极过评。2019年1月23日,北京市人民政府办公厅发布《关于改革完善仿制药供应保障及使用政策的实施意见》(京政办发〔2019〕2号),提到“提高仿制药一致性评价申报审批效率”“对承担仿制药一致性评价临床试验的医务人员,在职称晋升、科研奖励和绩效分配等方面予以支持”等措施,极大地提高了国内药企的过评积极性。经过3批带量采购,中标规则从1家增至8家,解决了过评企业无法中标的问题。由于依靠市场机制形成药品价格是我国政府带量采购的基本原则,故其中标规则实行淘汰制。在未来带量采购中尽早过评和占领市场,同等机会下能优先选择市场。因此,具有战略眼光的国内药企应尽快过评,但也要注意超过8家企业的品种和市场风险较高的问题。
综上所述,是否能通过仿制药一致性评价,即r1只有国内药企自己了解,政府难以获知,但可以提高过评品种的市场收益,如带量采购政策中只有过评品种才可参与,且可分享50%~80%的公立医疗机构市场。前3轮带量采购政策实施效果非常明显,未来国家层面还会进行500个品种的带量采购,地方政府则会进行其他药品的带量采购,还会优先采用过评品种,促使更多国内药企推进仿制药的一致性评价工作。
作者简介:
第一作者:马婷婷,女 ,回族 , 硕士研究生 , 研究方向为药事管理。
通信作者:邢花,女,博士研究生,副教授,研究方向为药事管理。
该文完整发布于《中国药业》杂志2021年2月5日出版的第30卷第3期第1~3页。
扫描下方二维码即可查看本文全文及本期杂志其他内容↓↓↓
